Az idegsejtek ösztrogénfüggő szabályozása és egy csokoládéról elnevezett átvivőanyag
Jól ismert, hogy a nők hajlamosak egy-egy szelet csokoládéval vígasztalni magukat. Hrabovszky Erikék munkája egy csokoládéról elnevezett peptid szerepének feltárásával segítheti, hogy sok nő legnagyobb bánata, a meddőség is egyszer gyógyítható lehessen.
Míg kontinenseken, ill. kontinensnyi országokban az ismeretterjesztéstől a rendszabályokon át a törvényekig mindent bevetnek a népesedés további növekedése ellen, a világ egyáltalán nem biztos, hogy boldogabb, de határozottan gazdagabb részében, egyre többen küzdenek azért, hogy gyerekük születhessen. Annak, hogy ezért küzdeniük kell, ezer és egy oka lehet. Bár manapság talán a fájdalmas tünetekkel is járó endometriózisról lehet a legtöbbet hallani, szintén gyakori a központi idegrendszer működésének zavara miatt kialakuló policisztás ovárium szindróma (PCOS), ahol a túlstimulált petefészek a meddőség oka. Ez a két - sajnos gyakori - betegség is a termékenységgel kapcsolatos kutatások széles kutatási területének megoldandó talányai közé tartozik.
De erről szóljon inkább Hrabovszky Erik, aki a neuroendokrinológia terén nemzetközi szaktekintély, és akivel a neves PNAS*-ben megjelent közleményük kapcsán beszélgettünk.
A folyóirat honlapján olvasható bemutatkozás szerint az itt megjelent közlemények "kivételes jelentőségű eredeti kutatások eredményeit ismertetik".
Cikket benyújtani vagy úgy lehet, hogy a szerzők úgy gondolják, közleményük valóban kivételes jelentőségű, ezért maguknak is megéri a benyújtással próbálkozni, vagy egy akadémiai taggal együttműködve próbálkoznak vele, a megadott szabályoknak megfelelő módon. Erikék cikkében számos szerző van, de egyik sem a NAS tagja.
- Kezdjük talán azzal, mi is az a neuroendokrinológia!
- A neuroendokrinológia egy viszonylag fiatal tudományág, mely az agy és a különböző belső elválasztású mirigyek közötti kétirányú funkcionális kapcsolattal foglalkozik.
- Mit jelent ez a "viszonylag fiatal" a neuroendokrinológia esetében?
- A huszadik század közepe táját, a múlt század ötvenes-hatvanas éveit - és sok esetben Magyarországot. Nemzetközi konferenciákon ma is tapasztalható, hogy a magyar neuroendokrinológia eredményeit és hagyományait sokan ismerik és elismerik külföldön. Nehéz is volna röviden felsorolni azokat a múlt században született alapvető felfedezéseket, melyeket a magyar neuroendokrinológiai iskoláknak köszönhet a világ. A vasfüggöny mögül is világraszóló szenzációt váltottak ki Szentágothai János munkacsoportjának eredményei. Ilyenek voltak például Halász Béla szellemes pályaátmetszési kísérletei a róla elnevezett “Halász késsel". Alkalmazásával jóval az agyalapi mirigyet szabályozó “felszabadító” és “felszabadulást gátló” hormonok (neurohormonok) felfedezését megelőzve tudták sikeresen behatárolni a mellső hipofízis lebenyt szabályozó hipotalamikus területeket, az úgynevezett “hipofizeotróf” régiókat, és itt írták le a szabályozást végző kissejtes neuroszekretoros rendszereket.
Pécsett, 1957-ben, mintegy három évtizeddel előzve meg az ösztrogént érzékelő receptor azonosítását, Flerkó Béla és Szentágothai János implantációs kísérletei igazolták először, hogy a petefészek ösztrogén hormonjai vissza is hatnak az agy működésére.
- Ezt hogyan sikerült bemutatniuk?
- A hipotalamusz területére ültettek be petefészek szövetet, melynek fennmaradó ösztrogén elválasztása lecsökkentette az agyalapi mirigy gonadotróp hormon szekrécióját!
A jelenséget ma már könnyen tudjuk klasszikus negatív ösztrogén visszacsatolásként értelmezni, melynek hátterében részben a szaporodást szabályozó GnRH (gonadotropin-releasing hormon) idegsejtek hormonelválasztásának ösztrogén általi gátlása áll. Hasonló negatív visszacsatolás egyébként szükségszerűen jellemzi a hipotalamusz szabályozása alatt álló többi hormontermelő mirigyet is.
- Mondanál erre néhány példát?
- A pajzsmirigy hormon vagy a mellékvesekéreg kortikoszteroid hormonjai is gátolják a hipotalamusz egyes specifikus neuroendokrin sejttípusainak, a TRH (thyrotropin-releasing hormon) ill. a CRH (corticotropin-releasing hormon) idegsejteknek a hormon elválasztását.
- Köszönöm a példákat, és térjünk is vissza a szaporodást irányító GnRH idegsejtekhez. Róluk mit tudunk?
- Szintén Pécsett, de már a nyolcvanas években, Merchenthaler István és Liposits Zsolt immunhisztokémiai munkái járultak jelentősen hozzá ezen idegsejtek anatómiai viszonyainak tisztázásához. Ekkortájt úgy tűnt, hogy a GnRH neuronok nem rendelkeznek az ösztrogén szintek érzékelésére alkalmas receptorral. Ezért aztán a következő évtizedek kutatásaiban nagy hangsúlyt kapott azoknak a rendszereknek a vizsgálata, melyek ösztrogén receptort tartalmaznak és egyúttal kapcsolatban állhatnak a GnRH idegsejtekkel.
- Liposits Zsolt professzor már több évtizede a KOKI-ban dolgozik!
- Így van. Tanítványaival, Kalló Imre és Fekete Csaba kollégáimmal együtt, már itt folytatták azokat a kísérleteket, melyek során több visszacsatolásban részt vevő, ösztrogén receptor tartalmú sejttípust is azonosítottak.
- Mi a feladata ezeknek az ösztrogén receptorral rendelkező idegsejteknek, és hogyan kerülnek kapcsolatba a GnRH sejtekkel?
- A vérben keringő ösztrogén hormonok szintje a nemi ciklus során hullámzik, ami az ösztrogén érzékeny idegsejtek működésében idéz elő ciklikus változásokat. Bár több ösztrogén receptor tartalmú idegsejt típus is közvetlen kapcsolatokat képez a GnRH neuronokkal, közöttük kiemelt jelentőségűek azok, melyek egy peptid természetű átvivőanyagot állítanak elő, mely felfedezőhelye, a pennsylvaniai Hershey csokoládéváros leghíresebb termékére utalóan a kisspeptin nevet kapta.
Ma úgy véljük, hogy az ösztrogén legfőbb hatásait ezek a kisspeptin sejtek közvetítik a kisspeptin receptort tartalmazó GnRH neuronok felé!
- Tehát az ösztrogén elsősorban közvetetten, a kisspeptinen keresztül hat a GnRH sejtekre?
- Ez jelentős egyszerűsítéssel, így van. Megjegyzem azonban, hogy 2000-ben pont mi mutattuk azt meg, hogy bizonyos ösztrogén hatások közvetlenül elérhetik a GnRH idegsejteket, az ún. béta típusú ösztrogén receptoron keresztül. Továbbá, olyan bonyolult biológiai folyamatok, mint a szaporodás, nagyon sérülékenyek volnának, amennyiben a természet nem gondoskodna némi párhuzamosságról is. Az azonban elmondható, hogy a kisspeptint vagy annak receptorát érintő genetikai mutációk a pubertás és a szaporodási képesség olyan hiányával járnak, melyet ösztrogén visszacsatolást közvetítő egyéb rendszerek nem tudnak kompenzálni. A GnRH idegsejtek ösztrogénfüggő szabályozásában külön érdekesség, hogy az ösztrogén a nemi ciklus fázisától függően képes mind serkenteni (pozitív feedback), mind gátolni (negatív feedback) a GnRH idegsejtek működését.
- A rendszer kétségkívül hatásosan működik, és minden bizonnyal jó oka van annak, hogy az ösztrogén nem közvetlenül hat a GnRH sejtekre. A negatív és pozitív visszacsatolásért ugyanazok az idegsejtek felelősek?
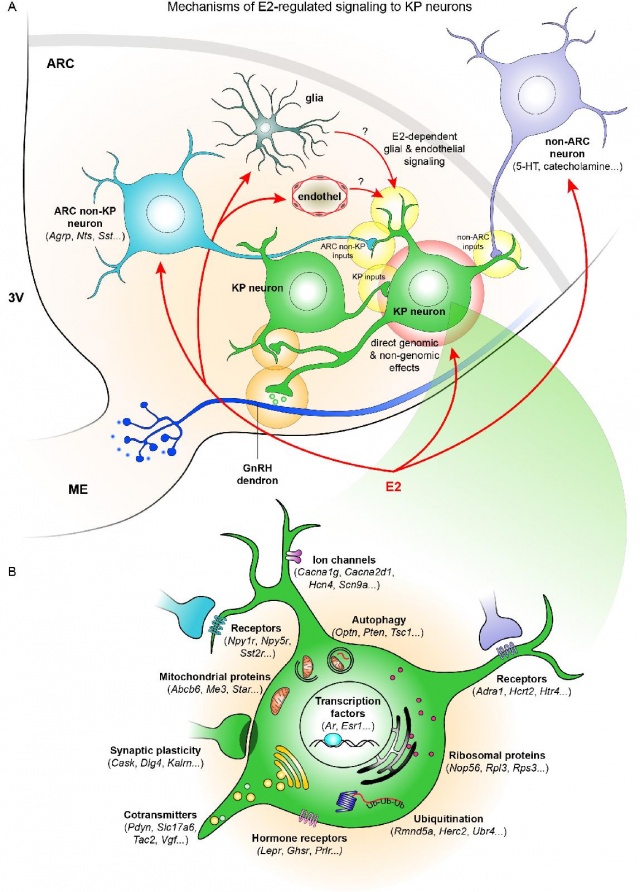
- A ciklus nagyrészében érvényesülő negatív visszacsatolásért elsősorban az arcuatus nevű idegmag kisspeptin neuronjai felelősek. A PNAS-ben Göcz Balázs elsőszerzőségével publikált cikkünk a negatív visszacsatolás hátterében álló molekuláris mechanizmusokat tárta fel.
- Mit sikerült felfedeznetek?
- A cikk átfogó képet kínál a kisspeptin idegsejtek ösztrogén szabályozás alatt álló génjeiről és funkcióiról. A munka gerincét egy nagy áteresztőképességű génexpressziós vizsgálat, az új generációs RNS szekvenálás adja.
- Ezt a technikát néhány hónapja az eLife-ban megjelent munkátokban is alkalmaztátok. Ismertetnéd pár szóval, hogyan történik egy ilyen vizsgálat?
- Kísérleteinkben egy génmódosított egér arcuatus idegmagvából lézer mikrodisszekciós eljárással (laser capture microdissection (LCM)) metszettük ki egyedileg és gyűjtöttük össze a génmódosításnak köszönhetően fluoreszkáló kisspeptin idegsejteket. Alacsony és magas ösztrogén szinttel rendelkező egérmodellek összehasonlító vizsgálatával mintegy 2300 ösztrogénfüggő gént azonosítottunk.
- Hatalmas szám! És milyen folyamatokat szabályoznak ezek az ösztrogén által szabályozott gének?
- Számos szabályozott gén volt például a mostanában a hosszú és egészséges élettel kapcsolatban is sokszor emlegetett autofágia (N=156), és ubikvitináció (N=45) folyamataival kapcsolatba hozható, míg a 126 ösztrogén által szabályozott receptor megjelenése arra világított rá, hogy a kisspeptin idegsejtek működését az idegi jelátvivő (neurotranszmitter) szerotonin és szomatosztatin, illetve az orexin nevű neuropeptid ösztrogénfüggő módon befolyásolja, egyéb rendszerek mellett.
- Ezt hogyan bizonyítottátok?
- Fény- és elektronmikroszkópos vizsgálatokkal is kimutattuk e transzmitterrendszerek axonvégződéseit a kisspeptin idegsejteken.
- Ez is szép munka lehetett, le a kalappal! Az eredmény tartalmazott-e számotokra meglepetést?
- Az egyik érdekes újdonság a kisspeptin neuronok korábban nem tanulmányozott szerotoninerg szabályozásának erőteljes ösztrogénfüggése volt. Magas ösztrogén szint három serkentő hatású szerotonin receptor szintjét is csökkentette, miközben egy gátló receptor szintjét megnövelte. Farkas Imre elektrofiziológiai kísérletekkel igazolta is, hogy magas ösztrogén szint jelenlétében a szerotonin kisspeptin idegsejtekre gyakorolt serkentő hatása jelentős mértékben csökken.
- Volt-e olyan, eddig nem említett eredmény, aminek különös jelentősége lehet a későbbiekben?
- A szekvenálási adatok értékelésekor számos olyan ösztrogénfüggő gént azonosítottunk, melyek szerepe a pubertást és a szaporodást érintő klinikai kórképekben már korábban felmerült. A kisspeptint kódoló Kiss1, a neurokinin B-t kódoló Tac2, vagy a neurokinin B receptorát kódoló Tacr3 géneket nem csupán erős ösztrogénfüggő szabályozás jellemzi, hanem ezek veleszületett hibája emberben a pubertás hiányát, “hipogonadotrop hipogonadizmust” is okoz.
Az általunk összeállított génlista alapján, egy svájci klinikai genetikus munkacsoporttal együttműködve, emberi beteganyagban sikerült potenciális betegségkeltő gének ritka variánsait azonosítanunk. E gének valós kóroktani szerepét persze további vizsgálatok kell, hogy megerősítsék, mivel a felhasznált “burden analysis” módszertan csupán statisztikai valószínűségre utal.
- Ha ennek még csak statisztikai is a valószínűsége, az már az eddig elmondottak alapján is nyilvánvaló, hogy ezekkel a kísérletekkel nem zárult le ez a kutatási projekt! Merre tovább?
- Az egyik érdekes irányt a pozitív, ill. negatív visszacsatolásért felelős két fő kisspeptin sejtcsoport eltérő ösztrogén általi szabályozása jelenti.
Göcz Balázs és Sárvári Miklós hamarosan befejezik azt a kéziratot, amely a tüszőrepedést (ovuláció) kiváltó pozitív ösztrogén visszacsatolás során aktiválódó, preoptikus kisspeptin sejtcsoport, valamint negatív visszacsatolásért felelős, arcuatus magbeli kisspeptin neuron populáció ösztrogénfüggő folyamatait és génjeit veti össze. Különösen izgalmas, hogy ugyanazon ösztrogén szint 34 gén ellentétes irányú expressziós változását idézte elő a két sejttípusban.
- Nem is kérdés, hogy érdemes folytatni! Megvan hozzá az eszköztáratok, vannak szakképzett, lelkes munkatársak is, de van-e rá pályázati pénzetek?
- Igen! A két kisspeptin sejtcsoportban az ösztrogén által inverz módon szabályozott gének egyike a Vgf. A Vgf szaporodással összefüggő szerepének vizsgálatára pedig tavaly sikerült elnyernünk egy OTKA pályázatot. Eddigi eredményeink alapján úgy tűnik, hogy a Vgf-ből lehasadó kisebb peptidek a kisspeptinéhez hasonló, fontos szerepet játszanak mind a pozitív, mind a negatív ösztrogén visszacsatolásban.
Emellett a kisspeptin idegsejtek génexpressziós vizsgálatával olyan izgalmas kérdéseket is vizsgálni tudunk, mint az éhezés vagy a magas prolaktinszint szaporodást gátló hatásának pontos mechanizmusa.
Azt is hozzá kell tennem, hogy az arcuatus idegmag kisspeptin idegsejtjeinek túlzott aktivitása kulcsszerepet játszik a női populáció akár 10-20%-át is érintő, a bevezetőben már említett PCOS kórkép létrejöttében. További fontos orvosi vonatkozás, hogy ugyanezen kisspeptin idegsejtek kóros aktivitás növekedése felelős a menopauzában oly sokak életét megkeserítő hőhullámok létrejöttéért is.
Az ösztrogén hiányos egér modell génexpressziós mintázatára vonatkozó megfigyelések ezért Göcz Balázs PNAS cikkében klinikai szempontból is érdekesek.
Ezen kívül a mostani cikkben felhasznált szekvenálási módszertant is publikálni szeretnénk!
- Úgy tűnik, a téma valódi aranybánya számotokra!
A PNAS cikk szerzői közül azonban többek neve nem került még szóba. Megneveznéd legalább azokat, akik a legtöbbet tették ezért a jelentős felfedezésért és sikerért?
- Az eredmények jelentős része a Reproduktív neurobiológia laboratórium munkatársainak, Göcz Balázsnak, Rumpler Évának, Sárvári Miklósnak, Skrapits Katalinnak, Takács Szabolcsnak, Farkas Imrének és Trinh Saroltának köszönhető. A társszerzők magas száma pedig azt mutatja, milyen sok értékes segítséget kaptunk házon belüli és külső munkatársaktól.
Göcz B., Rumpler É., Sárvári M., Skrapits K., Takács S., Farkas I., Csillag V., Trinh S.H., Bardóczi Z., Ruska Y., Solymosi N., Póliska S., Szőke Z., Bartoloni L., Zouaghi Y., Messina A., Pitteloud N., Anderson R.C., Millar R.P., Quinton R., Manchishi S.M., Colledge W.H. and Hrabovszky E. (2022) Transcriptome profiling of kisspeptin neurons from the mouse arcuate nucleus reveals new mechanisms in estrogenic control of fertility. PNAS
* Proceedings of the National Academy of Sciences of the United States of America, magyarul az USA Nemzeti Tudományos Akadémiájának Közleményei






